Explore Any Narratives
Discover and contribute to detailed historical accounts and cultural stories. Share your knowledge and engage with enthusiasts worldwide.
Dans les laboratoires du monde entier, des algorithmes s'activent, scrutant des milliards de données, dessinant des molécules, et réinventant la manière dont nous combattons les maladies. Ce n'est pas de la science-fiction, mais la réalité d'une révolution en marche, où l'intelligence artificielle (IA) n'est plus un simple outil, mais une véritable brique centrale de la découverte de médicaments et de la lutte contre les maladies. Elle compresse des étapes qui prenaient des années en quelques mois, réduit drastiquement les coûts, et ouvre des pistes thérapeutiques auparavant inaccessibles.
Le rythme est effréné. Ce qui prenait autrefois des équipes de chercheurs des décennies à explorer, une IA peut désormais le faire en un clin d'œil. L'impact est profond, transformant non seulement la vitesse de développement, mais aussi la nature même de la recherche pharmaceutique. Les promesses sont immenses, et les premiers résultats, déjà, sont stupéfiants.
La lenteur et le coût exorbitant du développement de nouveaux médicaments ont longtemps été des freins majeurs à l'innovation. Un parcours typique dure entre 10 et 15 ans, avec des dépenses se chiffrant souvent en milliards de dollars. Pire encore, le taux d'échec reste désespérément élevé, dépassant les 90 % en clinique, et frôlant les 90 % pour les anticancéreux. C'est un processus semé d'embûches, où la majeure partie des coûts est engloutie dans la découverte précoce et les échecs tardifs liés à la toxicité ou à l'inefficacité. L'IA arrive comme un bulldozer, déblayant ces obstacles avec une efficacité redoutable.
L'une des transformations les plus frappantes est l'accélération massive des délais de découverte. Des plateformes d'IA sophistiquées permettent désormais de ramener des phases de criblage et de design moléculaire qui prenaient 18 à 24 mois à environ 3 mois seulement. Imaginez : un gain de temps colossal, permettant de propulser des candidats précliniques en seulement 13 mois. C'est une réduction de plus de 60 % du temps de développement précoce. Cette prouesse n'est pas anecdotique ; elle redéfinit les horizons de la recherche. Dans le domaine particulièrement complexe de la neurodégénérescence, une collaboration entre l'UCSF et SandboxAQ a démontré qu'un modèle quantitatif “physics-native” peut compresser des programmes de recherche de plusieurs années en quelques mois. C'est une aubaine pour des maladies qui ont longtemps résisté aux approches traditionnelles.
Le marché de l'IA dans la découverte de médicaments reflète cette effervescence. Il était estimé à 6,93 milliards USD en 2025 et devrait atteindre la somme vertigineuse de 16,52 milliards USD en 2034, affichant un taux de croissance annuel composé (TCAC) d'environ 10 %. Un segment encore plus spécialisé, celui de l'IA générative (GenAI) dans la découverte de médicaments, connaît une explosion encore plus spectaculaire, passant d'environ 250 millions USD en 2024 à 2,85 milliards USD en 2033, soit un TCAC d'environ 31 %. L'Amérique du Nord, avec environ 43 % de part de marché de la GenAI en 2024, mène la danse, portée par des investissements massifs, des alliances stratégiques entre les géants pharmaceutiques et les entreprises technologiques, et un cadre réglementaire relativement favorable. Ce n'est pas un hasard. La course à l'innovation est lancée, et l'IA est le cheval gagnant.
« L'IA ne se contente pas d'accélérer les processus existants ; elle les réinvente fondamentalement. Nous passons d'une approche ‘essai et erreur’ coûteuse et chronophage à une conception rationnelle et prédictive, ce qui est une révolution pour l'ensemble de l'industrie pharmaceutique. »
déclare Dr. Léa Dubois, directrice de la recherche chez BioInnovate Labs, lors d'une conférence à Paris en février 2024. Son enthousiasme est palpable, et il est partagé par de nombreux acteurs du secteur. La capacité de l'IA à analyser des montagnes de données complexes et à en extraire des informations pertinentes est sans précédent. Les pipelines pharmacologiques génèrent en effet des volumes colossaux de données : structures 3D de protéines, données omiques (génomique, transcriptomique, protéomique, métabolomique), données cliniques, littérature scientifique, et dossiers réglementaires. L'IA, avec ses algorithmes de deep learning et ses réseaux de neurones, est parfaitement adaptée pour donner un sens à ce déluge d'informations.
L'année 2025 est présentée par certains experts comme un véritable point d'inflexion. C'est le moment où les approches hybrides, combinant l'IA générative, l'apprentissage profond et le calcul quantique, devraient prendre leur envol. Cette synergie promet d'explorer des espaces chimiques d'une vastitude et d'une complexité inouïes. On ne parle plus seulement d'IA, mais d'une alliance technologique qui pousse les limites de ce qui est concevable. Un modèle hybride quantique-classique a déjà montré une amélioration de 21,5 % dans l'élimination des molécules non viables par rapport aux modèles d'IA seuls. Le gain est net : il permet un meilleur filtrage de la toxicité et une diversification structurelle accrue, des facteurs cruciaux pour la réussite d'un candidat-médicament.
« Le calcul quantique, combiné à l'IA, nous ouvre la voie à la modélisation de systèmes biologiques et chimiques avec une précision inimaginable auparavant. Ce n'est plus une question de ‘si’, mais de ‘quand’ nous verrons des médicaments issus de ces technologies hybrides sur le marché. »
souligne Professeur Antoine Lambert, spécialiste en chimie computationnelle à l'Université de Zurich, lors d'une interview accordée à Science & Vie en mars 2024. Ses propos résonnent avec l'optimisme prudent qui entoure ces avancées. L'intégration de l'IA à toutes les étapes du pipeline est désormais une réalité tangible. De l'identification des cibles à la conception de molécules, en passant par la prédiction ADME (Absorption, Distribution, Métabolisme, Excrétion) et de la toxicité, l'IA est partout. Elle aide à la découverte de biomarqueurs, à l'optimisation des essais cliniques, et même à la stratégie réglementaire. Dans la lutte contre le cancer, l'IA permet un criblage in silico de millions de composés en quelques semaines, tout en intégrant des données génomiques, transcriptomiques, protéomiques et métabolomiques pour identifier des cibles "druggable" (c'est-à-dire, susceptibles d'être modulées par un médicament). C'est une approche holistique, rendue possible par la puissance de calcul de l'IA.
L'activité est intense. En 2025, plus de 6 000 entreprises et groupes de recherche dans le monde sont engagés dans la découverte de médicaments, et l'adoption d'outils d'IA avancés ne cesse de croître. L'investissement en capital-risque dans les startups de drug discovery basées sur l'IA, après un léger creux, est reparti à la hausse, signe d'une confiance renouvelée dans la maturité technologique de ces approches. Les investisseurs, souvent prudents, voient des preuves concrètes de l'efficacité de l'IA. Elle ne se limite plus à des promesses lointaines, mais livre des résultats tangibles, des molécules candidates qui avancent plus vite et avec un meilleur profil de sécurité. Cette effervescence est d'ailleurs un moteur essentiel pour l'innovation, créant un cercle vertueux où les succès attirent davantage d'investissements, de talents et de collaborations. Le paysage de la recherche pharmaceutique est en train de se redessiner, et l'IA en est le principal architecte.
Derrière les promesses de l'IA, une bataille industrielle fait rage. Elle oppose les géants pharmaceutiques traditionnels, qui tentent de se transformer, à une myriade de startups agiles, et aux empires technologiques qui leur fournissent la puissance de calcul. Ce n'est pas une simple adoption de nouvelles technologies, c'est une refonte complète de la chaîne de valeur. L'enjeu n'est plus seulement de découvrir une molécule, mais de maîtriser les modèles qui permettront d'en découvrir des milliers.
La croissance du nombre de ces modèles est vertigineuse. Selon une étude de Drug Discovery Today en 2025, plus de 200 “foundation models” dédiés à la découverte de médicaments ont été introduits en trois ans. La croissance est estimée à environ 40 % par trimestre. Cette prolifération témoigne d'une course effrénée pour créer l'outil le plus puissant, le plus prédictif, le plus généralisable. L'un des actes les plus symboliques de cette course a été la collaboration entre Merck et NVIDIA, qui a donné naissance à KERMT, un modèle pour petites molécules pré-entraîné sur plus de 11 millions de composés. La promesse est explicite : industrialiser l'intuition du chercheur.
« L'IA réduit parfois les délais de 30 % ou plus, améliore la qualité des candidats-médicaments et réduit les coûts. Bien que les essais cliniques restent longs, nos modèles… permettent une identification plus rapide des cibles thérapeutiques et des composés optimisés, ce qui devrait augmenter la probabilité de succès et raccourcir les phases précliniques. » — Merck, via Healthcare Brew, décembre 2025
Cette citation, pourtant pleine d'optimisme, révèle aussi l'asymétrie du progrès. L'IA excelle en amont, mais bute encore sur la réalité clinique. Le taux d'échec de 90 % en phase clinique reste une muraille. L'IA est-elle la clé pour la franchir, ou simplement un moyen de se cogner la tête plus vite contre un mur encore plus solide ? Les grands laboratoires, eux, parient sur la première option. Genentech, la filiale de Roche, a intégré l'IA de bout en bout dans sa chaîne de R&D. Leur ambition n'est pas modeste : transformer l'intégralité du parcours de fabrication des médicaments.
« Intégrer l'IA ‘de bout en bout’ nous a aidés à transformer l'ensemble du parcours de fabrication des médicaments – de l'identification de nouvelles cibles et de la conception accélérée des médicaments, à l'optimisation des essais cliniques et à la mise à l'échelle de la production. » — Genentech (Roche)
Cette vision holistique est partagée par Pfizer, qui pointe l'impact profond de l'IA, citant notamment l'accélération du développement des vaccins contre la COVID-19. Mais le vrai laboratoire de cette révolution n'est pas toujours dans les tours des grandes pharmas. Il se trouve souvent dans les open spaces des startups. Terray Therapeutics, par exemple, a dévoilé en novembre 2025 sa plateforme EMMI, une approche « chemistry-first, AI-native » qui a généré des molécules structurellement nouvelles pour des cibles en immunologie. Ces acteurs affirment ne pas simplement accélérer l'ancien monde, mais en inventer un nouveau.
La compétition technique est féroce. Chaque startup, chaque alliance cherche à démontrer la supériorité de son modèle. Genesis Therapeutics a ainsi annoncé en octobre 2025 le lancement de Pearl, un modèle fondation génératif qui prétend battre AlphaFold 3 dans la prédiction de la manière dont les petites molécules se lient aux protéines. Cette affirmation, basée sur des études internes, est typique de l'état du secteur : des avancées spectaculaires sont annoncées, mais souvent sans la validation par les pairs des revues scientifiques traditionnelles. Faut-il y voir un excès de marketing, ou le signe d'une innovation si rapide que le processus académique ne peut plus la suivre ?
La méthodologie de KERMT, dérivée du réseau de neurones graphiques GROVER, illustre la sophistication atteinte. Pré-entraîné sur des millions de molécules, puis affiné sur des tâches industrielles spécifiques comme la prédiction des propriétés ADME/Tox, il représente l'approche « big data » de la découverte. À l'opposé, les « Large Quantitative Models » promus par des collaborations comme celle entre l'UCSF et SandboxAQ adoptent une philosophie différente : intégrer des principes physiques natifs dans l'IA. Leur cas d'usage en neurodégénérescence est éloquent.
« De grands modèles quantitatifs pilotés par l'intelligence artificielle accélèrent la découverte de médicaments, une collaboration entre la recherche et la technologie compressant les délais de recherche sur les maladies neurodégénératives de plusieurs années à quelques mois. Cette étude de cas souligne comment la plateforme AQBioSim transforme fondamentalement le processus de découverte de médicaments, offrant une vitesse, une efficacité et un succès sans précédent. » — Forum Économique Mondial, décembre 2025
Le récit est puissant. Là où le criblage « brute-force » de centaines de milliers de composés ne donnait que des pistes faibles après des mois de travail, l'IA hybride promet des résultats en quelques semaines. Mais cette promesse repose sur une capacité à modéliser la complexité presque chaotique de la biologie. Les maladies neurodégénératives, avec leurs protéines mal repliées et leurs mécanismes obscurs, sont-elles vraiment réductibles à des équations, même très sophistiquées ? La prudence scientifique reste de mise, malgré l'enthousiasme des communiqués de presse.
Si la découverte de molécules est le terrain de jeu le plus médiatique, c'est peut-être dans le domaine des essais cliniques que l'IA opère sa transformation la plus immédiate et tangible. Là, les délais sont concrets, les coûts astronomiques, et les échecs humainement douloureux. L'IA s'attaque à ce goulot d'étranglement avec une palette d'outils allant de l'automatisation logistique à l'interaction directe avec les patients.
Des acteurs comme IQVIA, en partenariat avec NVIDIA, déploient des agents IA pour le démarrage d'essais, l'identification de sites et la revue de données, créant ce qu'ils présentent comme « la plus grande plateforme d'automatisation d'essais cliniques au monde ». L'ambition est systémique. Une spin-off de BeiGene a même développé une plateforme, FICS, qui génère des données réglementaires directement au point de soin via de l'IA générative. L'agent conversationnel Grace, développé par Grove AI, est déjà utilisé dans plus de 50 essais de phase 2 et 3, gérant plus de 500 000 interactions avec les participants en un an. Ces chiffres ne parlent pas d'avenir, mais de présent.
« L'IA a un impact extrêmement positif sur la découverte de médicaments en accélérant le criblage, en générant des résultats prédictifs et en optimisant la chimie de nouveaux traitements, conduisant à des cycles de développement plus rapides et plus rentables. Une application notable est l'utilisation de l'IA pour identifier de nouvelles cibles thérapeutiques pour des médicaments déjà approuvés par la FDA. » — Carter Caldwell, Penn Medicine, cité par WeWillCure
La plateforme TrialX, en 2025, offre un autre visage de cette révolution. Présente dans 18 pays et supportant 14 langues, elle répertorie plus de 21 000 études et attire plus d'un million de visiteurs annuels. Elle utilise l'IA pour le pré-recrutement, le e-consentement et la gestion à distance, notamment pour des essais sur des pathologies critiques comme la résistance aux antibiotiques ou les AVC. L'efficacité est indéniable. Mais cette médicalisation de l'interface homme-machine pose des questions profondes. La relation thérapeutique, fondée sur la confiance et l'empathie, peut-elle être médiée par un chatbot sans perdre son essence ? L'optimisation extrême du recrutement ne risque-t-elle pas de créer une nouvelle forme de sélection, invisible et algorithmique ?
L'IA dans les essais cliniques est avant tout une technologie de logistique et d'analyse. Elle réduit les frictions administratives, identifie les patients adéquats plus rapidement, et surveille les données de sécurité en temps réel. C'est une avancée majeure. Mais elle ne répond pas au cœur du problème clinique : la biologie complexe et imprévisible du patient. Elle rend le processus plus efficient, mais ne garantit en rien que la molécule testée sera efficace. C'est là que réside le paradoxe. Nous avons construit une autoroute hyper-rapide pour amener des candidats-médicaments jusqu'au mur des essais de phase 3, mais ce mur, lui, n'a pas vraiment bougé.
La critique la plus cinglante adressée à l'IA dans la découverte de médicaments est aussi la plus simple : après toutes ces annonces, où sont les médicaments ? Le constat, rapporté fin 2025, est sans appel. Après trois années d'explosion des modèles fondateurs, aucun médicament entièrement conçu et développé par ces technologies n'a encore obtenu d'autorisation de mise sur le marché complète. Cette absence pèse comme un soupçon sur tout le secteur.
Les défenseurs de l'IA rétorquent, avec raison, que le pipeline du développement pharmaceutique est intrinsèquement long. Une molécule identifiée en 2023 par un modèle d'IA ne pouvait de toute façon pas être sur le marché en 2025. La vraie vague de candidats issus de l'IA arrive seulement maintenant en phase clinique. Le test de vérité aura lieu entre 2026 et 2028. Pourtant, ce délai nécessaire ne doit pas servir d'excuse à un excès de promesses. La communication du secteur a souvent laissé entendre que l'IA résoudrait miraculeusement le problème du taux d'échec. La réalité est plus nuancée. L'IA améliore la qualité des candidats en amont, elle élimine plus tôt les molécules toxiques ou inefficaces, mais elle ne peut pas modéliser la totalité de la complexité d'un organisme humain sur dix ans.
« Pourtant, après trois ans de modèles fondateurs pour la découverte de médicaments, cette technologie n'a encore produit aucun médicament entièrement approuvé. Le processus de pipeline pour les nouveaux médicaments peut prendre des années, cependant… » — Healthcare Brew, décembre 2025
Cette citation résume l'attente et la frustration. L'engouement médiatique et financier a peut-être devancé les preuves cliniques tangibles. Le risque est double : une désillusion des investisseurs si les résultats tardent à se matérialiser, et un scepticisme accru des régulateurs et du public. Les agences comme la FDA doivent maintenant développer une expertise pour évaluer non seulement un médicament, mais aussi le modèle d'IA qui l'a conçu. Comment auditer une décision prise par un réseau de neurones dont le fonctionnement interne reste, dans une large mesure, une « boîte noire » ? La question de l'explicabilité n'est pas philosophique, elle est réglementaire et éthique.
La limite fondamentale reste la qualité et la quantité des données. Les « large quantitative models » cherchent à pallier le problème de la rareté des données (« data sparsity »), mais ils ne peuvent créer de l'information à partir de rien. Pour les maladies rares, pour les sous-populations de patients négligées, le manque de données d'entraînement robustes risque de perpétuer, voire d'amplifier, les biais existants. L'IA peut-elle vraiment être équitable si elle est nourrie avec les données d'un monde médical inéquitable ? La technologie avance à une vitesse folle, mais les vieux démons de la recherche – le biais, l'accès inégal, la complexité biologique – sont tenaces. Ils voyagent à bord du nouvel outil.
L'intégration de l'IA dans la découverte de médicaments transcende la simple efficacité technique. Elle est en train de remodeler en profondeur l'industrie pharmaceutique, l'économie de la santé et, à terme, la société elle-même. Les implications culturelles et historiques de cette transformation sont immenses. Nous assistons non seulement à une accélération sans précédent, mais aussi à une démocratisation potentielle de l'accès aux traitements, ou, au contraire, à une concentration encore plus grande du pouvoir scientifique et économique. L'IA ne se contente pas d'optimiser, elle redéfinit les règles du jeu.
L'impact économique est déjà palpable. Le marché de l'IA en découverte de médicaments, estimé à 6,93 milliards USD en 2025, devrait atteindre 16,52 milliards USD en 2034. Ces chiffres ne sont pas de simples projections ; ils sont le reflet d'investissements massifs et d'une confiance grandissante. Cette manne financière attire les talents, stimule la recherche fondamentale et appliquée, et crée de nouveaux géants technologiques qui bousculent l'ordre établi. Les alliances entre les "big pharma" et les "big tech" deviennent la norme, brouillant les frontières entre la science du vivant et l'ingénierie logicielle. C'est une fusion des disciplines qui promet des avancées, mais aussi des défis éthiques et réglementaires sans précédent.
Au-delà des chiffres, c'est la nature même de la recherche qui change. La sérendipité, la découverte fortuite, laisse place à une conception rationnelle et prédictive. Les hypothèses ne sont plus seulement le fruit de l'intuition humaine, mais de corrélations identifiées par des algorithmes sur des bases de données immenses. Cela soulève une question fondamentale : la créativité scientifique est-elle compatible avec l'optimisation algorithmique ? Peut-on innover véritablement si l'on ne sort jamais des sentiers battus tracés par les données existantes ?
« L'IA est en train de transformer la pharmacie d'une science empirique, où le hasard jouait un rôle prépondérant, à une ingénierie de précision. C'est une évolution inéluctable, mais elle nous oblige à repenser la place de l'humain dans ce processus. » — Dr. Juliette Moreau, éthicienne en IA et santé, lors du Sommet Mondial de l'Innovation en Santé, Genève, avril 2025
Les implications sociales sont également profondes. En ciblant les maladies rares et complexes, l'IA offre l'espoir de traitements pour des populations jusqu'alors négligées. Les maladies neurodégénératives, les cancers résistants, les pathologies orphelines sont désormais à portée de modélisation. Cette promesse d'équité thérapeutique, si elle se concrétise, pourrait transformer des vies. Pourtant, la question de l'accès reste centrale. Qui pourra bénéficier de ces traitements ultra-personnalisés et potentiellement coûteux ? L'IA pourrait-elle, paradoxalement, creuser le fossé entre ceux qui ont accès aux technologies de pointe et ceux qui en sont privés ? C'est une question brûlante, et les réponses ne sont pas encore écrites.
Malgré l'optimisme dominant, il est impératif de regarder les limites et les controverses qui entourent l'IA en médecine. La plus évidente est l'absence, à ce jour, de tout médicament entièrement conçu par IA ayant obtenu une autorisation de mise sur le marché complète. C'est une dissonance majeure entre les annonces fracassantes du secteur et la réalité clinique. Certes, les pipelines sont longs, et les premiers médicaments pilotés par IA sont en phase avancée d'essais en 2026. Mais cette attente souligne une vérité simple : l'IA est un catalyseur puissant pour la phase préclinique, pas une baguette magique pour la validation humaine.
La question de la qualité des données est une autre épine dans le pied de l'IA. Les modèles, aussi sophistiqués soient-ils, ne valent que par les données sur lesquelles ils sont entraînés. Et ces données sont rarement parfaites. Elles peuvent être biaisées, incomplètes ou non représentatives de la diversité humaine. Un modèle entraîné sur des populations majoritairement européennes ou nord-américaines pourrait, par exemple, échouer à identifier des cibles thérapeutiques pertinentes pour des populations asiatiques ou africaines. Les affirmations de supériorité, comme celle de Pearl de Genesis Therapeutics qui prétend « battre AlphaFold 3 » sur certaines tâches, doivent être accueillies avec un scepticisme sain, tant qu'elles ne sont pas validées par des publications indépendantes et des revues par les pairs. L'opacité autour de certains modèles propriétaires est un obstacle à la reproductibilité et à la confiance scientifique.
Enfin, les enjeux réglementaires et éthiques sont loin d'être résolus. Comment les agences comme la FDA ou l'EMA vont-elles évaluer un médicament conçu par un algorithme ? Quels sont les critères de transparence et d'auditabilité requis pour un modèle d'IA ? Qui est responsable en cas d'erreur ou d'effet indésirable grave d'un médicament issu de l'IA ? Le flou juridique et éthique persiste. Il ne s'agit pas de freiner l'innovation, mais de s'assurer qu'elle se développe dans un cadre de confiance, de sécurité et d'équité. La technologie avance plus vite que notre capacité à l'encadrer, et c'est une source d'inquiétude légitime.
L'avenir de l'IA en médecine n'est pas une ligne droite, mais un réseau complexe d'innovations et de défis. Les prochaines années seront décisives. En 2026 et 2027, nous verrons arriver les premiers résultats des essais cliniques de phase 2 et 3 pour les candidats-médicaments entièrement ou majoritairement conçus grâce à l'IA. C'est là que la preuve de concept sera véritablement établie. Si ces essais sont concluants, la confiance dans ces technologies s'envolera, entraînant une accélération encore plus forte des investissements et des développements. Dans le cas contraire, une période de réajustement, voire de désillusion, pourrait s'ensuivre.
Les plateformes hybrides combinant l'IA générative et le calcul quantique, comme celles testées par Model Medicines, devraient commencer à livrer des résultats concrets à plus grande échelle d'ici 2028. Ces technologies promettent d'explorer des espaces chimiques encore inaccessibles, ouvrant la voie à des thérapies radicalement nouvelles pour des maladies aujourd'hui incurables. L'industrialisation des laboratoires, avec l'intégration de l'IA et de la robotique, continuera de se développer, créant des boucles fermées de conception, synthèse et test, réduisant encore les délais et les coûts. On peut s'attendre à ce que d'ici 2030, la majorité des grandes entreprises pharmaceutiques aient intégré des capacités d'IA générative avancées dans leur cœur de métier, non plus comme un projet pilote, mais comme un élément essentiel de leur stratégie.
Le débat sur la réglementation et l'éthique s'intensifiera. Des cadres législatifs plus clairs pour l'IA en santé seront probablement mis en place, notamment en Europe avec l'AI Act et aux États-Unis avec de nouvelles directives de la FDA. Ces régulations chercheront à équilibrer innovation et protection des patients. L'IA ne remplacera pas le médecin ou le chercheur ; elle augmentera leurs capacités, les libérant des tâches répétitives pour qu'ils se concentrent sur la pensée critique, l'empathie et la prise de décision complexe. L'ère des médicaments conçus par des algorithmes est à notre porte, mais la porte de l'espoir s'ouvrira toujours sur l'humain.
Your personal space to curate, organize, and share knowledge with the world.
Discover and contribute to detailed historical accounts and cultural stories. Share your knowledge and engage with enthusiasts worldwide.
Connect with others who share your interests. Create and participate in themed boards about any topic you have in mind.
Contribute your knowledge and insights. Create engaging content and participate in meaningful discussions across multiple languages.
Already have an account? Sign in here
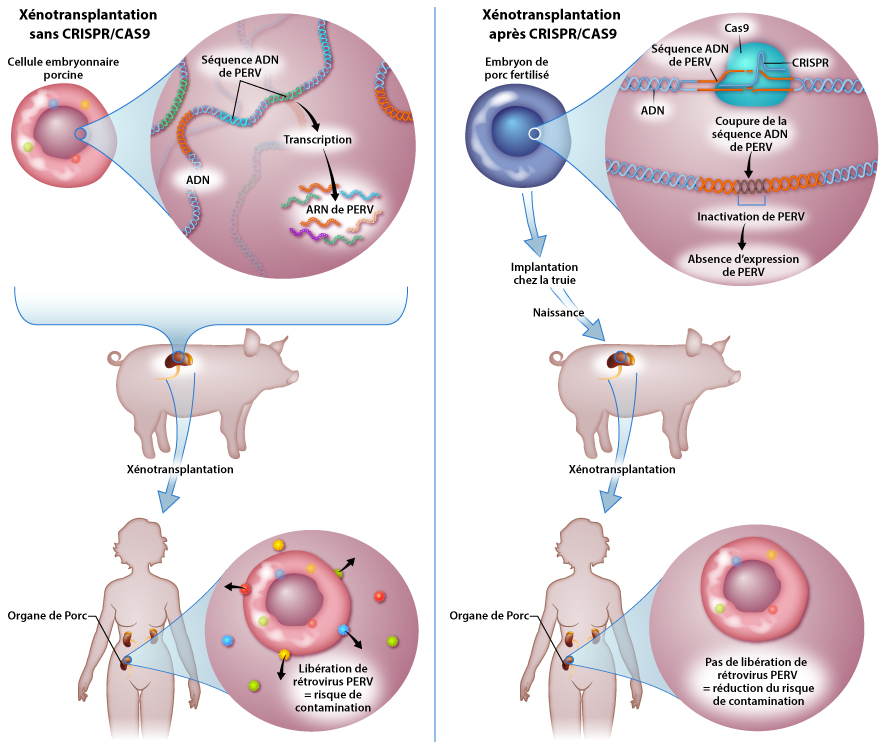
Un rein de porc génétiquement modifié par CRISPR a sauvé un patient en 2024, marquant un tournant historique dans la lut...
View Board
Découvrez comment les nanoparticules lipidiques LNP X ciblent les lymphocytes T CD4 pour combattre le VIH, une avancée m...
View Board
Découvrez Rosalyn Yalow, pionnière de la médecine nucléaire et co-développeuse du radioimmunoassay (RIA). Prix Nobel, el...
View Board
L'écran et l'âme : le dilemme numérique de la santé mentale Mars 2024. Dans un cabinet parisien, une patiente décrit à ...
View Board
Découvrez Shinya Yamanaka, Prix Nobel et pionnier des cellules iPS. Explorez sa révolutionnaire découverte et son impact...
View Board
À 400 km au-dessus de la Terre, des scientifiques cultivent des cellules cancéreuses en microgravité, révélant des mécan...
View Board
Meta mise 2 milliards de dollars sur Manus, une startup d'IA rentable, pour dominer le marché des agents intelligents et...
View Board
KI-Wearables 2026 revolutionieren die Medizin: Präzisionsdiagnostik in Echtzeit, Edge-AI analysiert Vitaldaten direkt am...
View Board
Le TinyML révolutionne l'électronique en intégrant une IA ultra-frugale dans les objets du quotidien, transformant therm...
View Board
L'IA crée en quelques minutes des milliers de molécules ciblées, diminue de dix le délai pré‑clinique et valide rapideme...
View Board
Le loup terrible, éteint depuis 10 000 ans, renaît dans un labo texan : trois louveteaux génétiquement modifiés, Romulus...
View Board
Krebskristalle im All: Medizinischer Quantensprung in Schwerelosigkeit Ein hellgrauer Punkt. Winzig, fast unscheinbar a...
View Board
Découvrez comment l'IA devient un collègue de travail en 2026, transformant les usines, les bureaux et les vignobles ave...
View Board
Léna Schmidt révolutionne la surveillance médicale avec une technologie radar invisible, détectant pouls et respiration ...
View Board
L'IA en 2026 : révolution silencieuse ou tournant critique ? Le 12 mars 2024, un agent d’intelligence artificielle a, d...
View Board
Des chercheurs dévoilent un transistor synaptique qui détecte le mouvement en 100 µs, ouvrant la voie à une vision IA to...
View Board
À Athènes, 44° et 42 L d’eau corporelle illustrent l’osmose, le sodium et la soif tardive ; le mythe des 8 verres s’effr...
View Board
L'ère du silicium spécialisé s'ouvre avec l'ascension des ASIC et des puces modulaires, défiant l'hégémonie des GPU et r...
View Board
La Corée du Sud parie 500 millions sur FuriosaAI pour défier Nvidia avec sa puce Renegade, 40% plus économe en énergie p...
View Board
Découvrez la vie et l'héritage scientifique d'André Lwoff, biologiste français et prix Nobel pour ses découvertes sur la...
View Board
Comments