Explore Any Narratives
Discover and contribute to detailed historical accounts and cultural stories. Share your knowledge and engage with enthusiasts worldwide.
Le 6 février 2025, un laboratoire publie les schémas d’une nouvelle nanoparticule lipidique, une sphère minuscule nommée LNP X. Son design est spécifique, presque élégant. Il ne cible pas les cellules musculaires, comme pour un vaccin classique. Il cherche, avec une précision inouïe, les lymphocytes T CD4 au repos, ces cellules rares et silencieuses qui abritent le réservoir latent du VIH. Ce jour-là, une technologie utilitaire devient un pinceau. Une plateforme de livraison devient un véhicule pour l’espoir le plus complexe de la médecine moderne : une cure.
L’histoire des vaccins à ARN messager contre le virus de l’immunodéficience humaine n’est pas une simple chronique scientifique. C’est un récit d’ambition technique et de défi biologique monumental. Après le triomphe mondial contre la COVID-19, la plateforme ARNm-LNP se tourne vers son adversaire le plus coriace. Les résultats préliminaires, notamment ceux publiés dans Science en décembre 2024, sont prometteurs mais fragiles, comme les premières esquisses d’une fresque qui couvrirait un continent. Nous ne sommes plus dans l’urgence pandémique, mais dans la lente et méticuleuse quête d’un Graal. L’art ici réside dans le design des immunogènes, dans l’architecture des nanoparticules, et dans la chorégraphie séquentielle des injections qui doivent guider, pas à pas, le système immunitaire vers une réponse qu’il ne produit presque jamais naturellement.
La révolution ARNm, née dans le feu de la COVID-19, a légué deux outils précieux : une plateforme de fabrication rapide et industrialisable, et une boîte à outils de nanoparticules lipidiques éprouvée. Mais passer du SARS-CoV-2 au VIH, c’est comme passer de la sculpture sur bois à la taille du diamant. Le coronavirus présentait une protéine de pointe relativement stable, un point d’entrée vulnérable. Le VIH, lui, est un illusionniste de l’évolution. Son enveloppe, la protéine Env, est un chef-d’œuvre de camouflage, lourdement glycosylée, constamment mutante, cachant ses rares points faibles avec une efficacité dévastatrice. Le virus s’intègre aussi dans notre ADN en quelques jours, créant un réservoir latent que le système immunitaire ne voit pas. Un vaccin préventif ne doit pas seulement déclencher une réponse ; il doit forger une arme d’une précision et d’une puissance exceptionnelles : les anticorps neutralisants à large spectre, ou bnAbs.
Ces bnAbs sont si rares que leur découverte chez certains patients vivant avec le VIH a été une surprise. Les induire par la vaccination représente le Saint-Graal de la recherche. Les approches protéiques traditionnelles, testées depuis des décennies, ont buté sur cette difficulté. L’ARNm, lui, offre une nouvelle palette. Au lieu d’injecter la protéine finie, il livre le plan de construction à nos propres cellules. Cela permet à la protéine Env d’être produite et présentée à la surface cellulaire dans une conformation dite « native-like », plus fidèle à sa structure sur le virus réel. C’est la différence entre étudier un oiseau empaillé et l’observer en vol.
« Les données précliniques montrent qu'une expression génétique de trimères Env native-like via ARNm-LNP peut générer des réponses humorales de qualité, rapprochant cette stratégie des meilleurs immunogènes protéiques actuels », explique une revue de Frontiers in Immunology de 2024.
Mais produire l’enveloppe n’est que la première étape. Le véritable art contemporain de cette science s’appelle le germline-targeting (ciblage des lignées germinales). L’idée est séquentielle, presque narrative. Le premier vaccin, le « primo-immunogène », est conçu comme un appât parfaitement calibré. Il ne vise pas n’importe quel précurseur d’anticorps. Il cherche et active spécifiquement les cellules B rares, celles qui ont le potentiel de devenir, après un long processus de maturation, des productrices de bnAbs. C’est l’amorce.
Ensuite commence une série d’injections de rappel. Chaque nouveau vaccin ARNm de la série code pour une version légèrement modifiée de l’immunogène. Chaque version est conçue pour « sélectionner » et favoriser les cellules B dont les anticorps se rapprochent, mutation après mutation, de la forme idéale capable de neutraliser une large variété de souches du VIH. On guide délibérément l’évolution somatique, un processus qui prend normalement des années dans le corps, pour le comprimer en quelques mois.
L’étude de Science de 2024 a démontré la faisabilité de cette amorce chez l’humain. C’était une preuve de concept cruciale, montrant que la première étape de cette chorégraphie complexe pouvait être exécutée. Mais le chemin reste long. Aucun candidat vaccin ARNm contre le VIH n’a dépassé la phase 1 des essais cliniques. Nous sommes dans l’atelier, à tester les pigments et les textures, bien loin de l’exposition universelle.
« L’ARNm-LNP est privilégié pour cette série modulaire rapide, permettant d’ajuster les immunogènes au fur et à mesure des données structurales et immunologiques », note un expert interrogé par Gavi, l’Alliance du Vaccin, dans une prospective 2026.
La modularité est ici l’atout maître. Si les données d’un essai montrent que la maturation des anticorps dévie, les chercheurs peuvent rapidement re-concevoir l’immunogène de la prochaine injection. C’est un processus itératif et réactif, impensable avec les longues méthodes de production de protéines recombinantes.
Pendant que les vaccins préventifs poursuivent leur lente maturation, un autre front s’ouvre, plus audacieux encore : celui de la guérison. Ici, l’artiste ne travaille plus avec le système immunitaire naïf d’une personne séronégative, mais doit intervenir dans le paysage cellulaire complexe et établi d’une personne vivant avec le VIH. Le défi est de taille : atteindre des cellules réservoirs qui sont non seulement rares, mais aussi dans un état de repos profond, notoirement difficiles à pénétrer.
C’est là que des créations comme la LNP X entrent en scène. Sa performance technique est spécifique : pénétrer les lymphocytes T CD4 au repos sans les activer de façon dangereuse, et y délivrer sa cargaison d’ARNm. Que peut-on faire avec cet accès ? Les possibilités deviennent de la science-fiction devenue pinceau. On peut y envoyer un ARNm codant pour la protéine Tat du VIH, pour « réveiller » délibérément le virus dormant dans sa cachette (c’est la stratégie dite « shock » du shock and kill). On peut y envoyer les composants du système CRISPR pour activer de manière ciblée le promoteur viral et obtenir le même effet. On peut même imaginer y délivrer des instructions pour des récepteurs immunitaires sur mesure.
Cette approche ne cherche pas à prévenir l’infection, mais à la traiter de manière si profonde qu’elle pourrait mener à une rémission durable, une cure fonctionnelle. Elle fusionne la vaccinologie et la thérapie génique. La nanoparticule lipidique cesse d’être un simple vecteur ; elle devient un chirurgien moléculaire, un infiltré.
Les réactions à ces avancées sont mitigées, et c’est normal. L’enthousiasme pour la plateforme ARNm se heurte à la réalité têtue du VIH. Certains essais précoces ont signalé des réactions cutanées locales plus marquées, rappelant que la tolérance à long terme de schémas vaccinaux séquentiels avec des LNP doit être scrutée. Et surtout, le problème fondamental n’est pas résolu par la plateforme. « LNP est un véhicule merveilleux, mais il faut encore savoir où aller », pourrait-on dire. Le design des immunogènes pour le germline-targeting reste un problème de biologie structurale de premier ordre. La beauté de la nanoparticule est inutile si le message qu’elle porte est imparfait.
Nous nous trouvons donc à un carrefour esthétique et scientifique fascinant. D’un côté, une technologie qui a prouvé sa puissance et sa rapidité. De l’autre, un ennemi biologique d’une complexité décourageante. La fusion des deux crée un terrain d’expérimentation sans précédent, où chaque avancée, chaque échec, redessine les contours du possible. La suite de cette histoire ne se joue pas seulement dans les éprouvettes, mais dans la manière dont nous parvenons à appréhender la subtilité infinie d’un virus qui, depuis quatre décennies, défie l’imagination médicale. La prochaine étape exige plus que de la rigueur ; elle exige une forme de génie.
Imaginez un compositeur qui doit écrire une symphonie pour un orchestre qui n'existe pas encore. Il doit d'abord construire les instruments, puis enseigner à chaque musicien une partition si complexe qu'elle défie les lois acoustiques habituelles. C’est précisément la tâche des équipes de recherche de Scripps, du NIH, ou de l’IAVI qui conçoivent les immunogènes pour les vaccins ARNm contre le VIH. Leur travail s’éloigne radicalement de la science empirique brute pour entrer dans le domaine du design pur, presque de la haute couture moléculaire. Chaque acide aminé, chaque sucre de glycosylation sur la protéine Env devient un choix esthétique et fonctionnel. Une torsion de 3,7 degrés peut faire la différence entre un anticorps médiocre et un bnAb naissant.
L’étude publiée dans Science le 13 décembre 2024 par des chercheurs du Scripps Research Institute est l’exemple parfait de cette nouvelle discipline. Ils n’ont pas testé un vaccin au hasard. Ils ont délibérément conçu une nanoparticule lipidique porteuse d’un ARNm codant pour un immunogène nommé eOD-GT8 60mer. Ce nom cryptique cache une ambition folle : cette structure est un leurre parfaitement calibré pour s’accrocher à une famille extrêmement rare de cellules B, les précurseurs des anticorps VRC01. Ces précurseurs ne représentent qu’une cellule sur un à trois millions. L’expérience a fonctionné. L’amorçage a eu lieu chez des volontaires humains. C’est un triomphe du design sur le hasard.
« Cette stratégie de vaccination séquentielle est comme un programme d'entraînement très précis pour le système immunitaire. Chaque injection est un nouvel exercice, plus difficile, pour pousser les cellules B à se spécialiser », résume un immunologiste du projet IAVI, en marge des résultats de l'essai IAVI G002.
Mais voici le revers de la médaille, l’ombre portée de cette approche ultra-rationnelle. Cette précision chirurgicale crée une fragilité vertigineuse. Le moindre écart dans la conformation de l’immunogène, la plus petite imperfection de fabrication des LNP, pourrait envoyer la réponse immunitaire sur une fausse piste. On guide le système vers une cible mouvante, car le virus lui-même mute sans cesse. La stratégie actuelle repose sur une série linéaire et prédéterminée de vaccins. Mais que se passe-t-il si le système immunitaire d’un individu prend un raccourci, dévie de la trajectoire prévue ? Le programme élégant pourrait tourner au bug informatique. La beauté du design peut être son talon d’Achille.
Il y a dans cette quête une arrogance nécessaire, mais une arrogance tout de même. Nous présumons que nous pouvons non seulement comprendre, mais aussi chorégraphier l’un des systèmes les plus complexes et adaptatifs de la nature. Les approches vaccinales traditionnelles jouaient un rôle plus modeste : présenter un danger, et laisser le système immunitaire improviser sa réponse. Ici, nous écrivons la réponse à l’avance. C’est la différence entre montrer une photo d’un lion à quelqu’un et lui apprendre, mouvement par mouvement, un art martial spécifique pour vaincre ce lion précis.
Cette logique déterministe atteint son paroxysme avec les travaux sur la LNP X pour la cure. L’article de Nature Communications, repris par The Body Pro en juin 2025, ne décrit pas seulement un outil. Il décrit un nouveau pouvoir : la capacité de pénétrer le sanctuaire cellulaire, l’état de repos, et d’y déposer un message génétique programmable. On peut y voir une prouesse technique absolue. On peut aussi y percevoir une inquiétude. En cherchant à réveiller le réservoir latent avec un ARNm codant pour Tat, nous jouons avec le feu de l’activation immunitaire incontrôlée. La ligne entre la réactivation ciblée (« shock ») et une tempête de cytokines est ténue. L’histoire du VIH est jonchée d’échecs thérapeutiques où une logique parfaite en laboratoire s’est brisée sur la roche imprévisible de la biologie humaine.
Les formulations muqueuses, évoquées dans une revue de 2024, ajoutent une autre couche de complexité. Développer un gel ou un spray rectal ou vaginal à base d’ARNm-LNP pour induire une immunité locale IgA est une idée séduisante, presque évidente pour un virus qui entre par les muqueuses. Mais les muqueuses sont un environnement biochimique hostile, conçu pour dégrader les intrus. Adapter les LNP, ces délicates bulles de graisse, à survivre à cet environnement relève de l’exploit. Chaque tentative ressemble à la création d’une nouvelle forme d’art éphémère, destinée à être absorbée et transformée par le corps en un temps record.
L'euphorie post-COVID autour de l'ARNm a déclenché une ruée vers l'or scientifique. Les financements pour la plateforme ont afflué, les start-ups se sont multipliées, et les annonces de percées se succèdent dans les communiqués de presse. Le VIH, avec son marché potentiel immense et son prestige scientifique, est devenu une cible prioritaire. Moderna a son essai de phase 1 (mRNA-1644 et mRNA-1574). BioNTech explore des collaborations. La compétition est féroce, et le battage médiatique l'est tout autant.
Cette dynamique de marché crée une tension culturelle fascinante dans le monde de la recherche. D’un côté, elle accélère les découvertes par la compétition. De l’autre, elle risque de biaiser le récit. Chaque résultat préclinique positif sur des souris ou des lapins est présenté comme une « avancée majeure ». Chaque entrée en phase 1, qui n’est qu’un test de sécurité très préliminaire, devient un « espoir tangible ». Cette inflation sémantique érode la confiance des communautés les plus concernées, en particulier les personnes vivant avec le VIH et les groupes à haut risque, qui ont été brûlés par des promesses non tenues pendant quarante ans.
« Il faut être extrêmement prudent avec le message. Nous sommes encore au tout début. Avoir un candidat en phase 1 en 2025 ne signifie pas un vaccin en 2028. Pour le VIH, chaque étape est un gouffre qu'il faut traverser avec une extrême prudence », met en garde une chercheuse principale du réseau HVTN (HIV Vaccine Trials Network), lors d'un symposium en mars 2025.
La question de l’éthique de l’attente devient centrale. Comment communiquer un espoir réaliste sans nourrir un faux espoir ? Les essais cliniques pour ces vaccins de nouvelle génération sont longs, coûteux, et requièrent l’engagement altruiste de milliers de volontaires séronégatifs. Leur recrutement dans des populations souvent marginalisées ou précaires pose des questions de justice sociale anciennes, mais ravivées par la technicité du discours. Expliquer le concept de « germline-targeting » et de « maturation dirigée des anticorps » à un public non scientifique est un défi en soi. Le risque est de créer une nouvelle forme d’élitisme biomédical, où seuls les initiés comprendraient les enjeux des traitements de demain.
Et puis, il y a l’ombre portée des vaccins COVID-19. Leur succès a établi un précédent dangereux : l’attente d’une solution rapide, développée en un temps record. Appliquer cette attente au VIH est une erreur catastrophique. Le SRAS-CoV-2 était une cible simple. Le VIH est un chef-d’œuvre de l’évasion. La plateforme est la même, mais la cible est d’une complexité d’un autre ordre. La société doit accepter que la prochaine grande œuvre de la vaccinologie sera un travail de longue haleine, fait d’essais, d’erreurs, et de révisions constantes. Ce n’est pas un sprint, c’est la sculpture d’une montagne.
Ce qui émerge finalement de cette effervescence, c’est un nouveau langage esthétique pour décrire la science. Les articles de recherche regorgent désormais de termes comme « élégant », « ingénieux », « design rationnel ». La beauté d’une structure cristallographique de trimère Env stabilisé est commentée avec la même ferveur que la composition d’un tableau. Les visualisations 3D des nanoparticules lipidiques, avec leurs couches de phospholipides ordonnées comme les cercles d’un tronc d’arbre, circulent sur les réseaux sociaux. La science du VIH devient une science visuelle, presque tactile.
Cette esthétisation a une fonction. Elle rend palpable l’abstraction moléculaire. Elle attire les talents. Elle séduit les bailleurs de fonds. Mais ne nous y trompons pas : derrière la beauté des modèles informatiques et la grâce des séquences vaccinales se cache un ennemi d’une laideur efficace et d’une résistance monstrueuse. Le virus lui-même est une œuvre d’art perverse, un chef-d’œuvre de l’adaptation et de la survie. La bataille entre le vaccin ARNm et le VIH n’est pas seulement une bataille biologique. C’est un duel d’artistes, l’un cherchant à créer une défense parfaite, l’autre ayant perfectionné l’art de l’infiltration et du déguisement.
Où cela nous mène-t-il ? Vers une nouvelle relation entre la science et le public, où la complexité est assumée et même valorisée. Vers une reconnaissance que les plus grandes avancées ne sont plus des découvertes fortuites, mais des constructions délibérées, lentes et méticuleuses. Le vaccin ARNm contre le VIH, qu’il aboutisse ou non, aura déjà transformé notre culture scientifique. Il nous aura appris à regarder le système immunitaire non comme une force brute à mobiliser, mais comme un instrument de précision infinie à accorder. Et à accepter que face à un chef-d’œuvre de la nature, il faut parfois en créer un autre pour le contrer.
L'importance des vaccins ARNm contre le VIH dépasse largement la quête d'un seul produit. Elle marque un tournant fondamental dans notre façon de concevoir la médecine préventive et thérapeutique. Après l'ère des vaccins empiriques, développés par atténuation ou inactivation, puis celle des vaccins sous-unitaires protéiques, nous entrons dans l'ère du vaccin programmé. Ce n'est plus seulement un antigène que l'on injecte, c'est une instruction que l'on livre. Cette transition est aussi profonde que le passage de la médecine des humeurs à la médecine moléculaire. La plateforme ARNm-LNP, forgée dans l'urgence de la COVID-19, trouve dans le VIH son défi ultime, son test de résistance absolu. Si elle peut contribuer à vaincre ce virus, elle pourra affronter n'importe quel autre agent pathogène.
Culturellement, cette recherche réécrit le récit de la lutte contre le VIH. Pendant des décennies, le discours a été celui du siège, de la défense, de la gestion chronique. Les antirétroviraux furent une victoire immense, mais ils laissaient intacte la perspective d'une vie sous traitement perpétuel. Les stratégies de germline-targeting et de chasse au réservoir latent portées par l'ARNm réintroduisent le langage de l'offensive, de l'éradication, voire de la guérison. Elles redonnent une place centrale à la notion de vaccin, non plus comme un outil de santé publique parmi d'autres, mais comme l'instrument d'une possible fin de l'épidémie. Cette ambition change la psychologie de toute une communauté.
« Nous ne sommes plus dans l'ère de la découverte fortuite. Nous sommes dans l'ère de l'ingénierie délibérée. Le VIH nous force à passer du bricolage génial au design de précision. C'est une transition qui influencera toute la vaccinologie du XXIe siècle », affirme un directeur de recherche du Vaccine Research Center aux NIH, lors d'une conférence interne en avril 2025.
L'impact sur l'industrie est tout aussi tangible. La course aux vaccins ARNm contre le VIH a déjà accéléré l'innovation dans des domaines adjacents : la stabilisation des ARNm, le ciblage cellulaire spécifique des LNP, les formulations pour administration muqueuse. Les brevets déposés autour des LNP X et de leurs dérivés dessinent une nouvelle cartographie de la propriété intellectuelle en biotechnologie. Les essais cliniques en cours, comme l'essai de phase 1 de Moderna (NCT05001373) ou les études de l'IAVI, ne testent pas seulement des produits. Ils testent un nouveau paradigme industriel, où l'agilité et la modularité priment sur la production lourde de protéines recombinantes.
Derrière l'enthousiasme légitime se cachent des faiblesses structurelles qu'il serait malhonnête de passer sous silence. La première est d'ordre biologique : l'obsession pour les bnAbs. Cette focalisation est compréhensible, mais elle pourrait être un piège. Le virus du VIH est un maître de l'évasion. Même si nous parvenons à induire ces anticorps rares et puissants, rien ne garantit que le virus ne trouvera pas de voie de contournement. L'histoire du VIH est une course aux armements où le virus a toujours eu un coup d'avance. Mettre tous ses espoirs dans une seule classe de réponse immunitaire, aussi élégante soit-elle, est un pari risqué.
La deuxième faiblesse est économique et géopolitique. La complexité de fabrication des vaccins ARNm-LNP, les chaînes d'approvisionnement en lipides spécialisés, la nécessité d'une chaîne du froid robuste, tout cela crée un produit intrinsèquement cher et logistiquement lourd. Les vaccins COVID-19 ARNm ont largement bénéficié aux pays riches. Un vaccin contre le VIH, s'il voit le jour, sera-t-il accessible aux populations d'Afrique subsaharienne, qui en ont le plus besoin ? La beauté d'une molécule ne sert à rien si elle reste enfermée dans un coffre-fort technologique. L'initiative du « mRNA Technology Transfer Hub » de l'OMS est un pas, mais il reste timide face à l'ampleur des besoins.
Enfin, il y a un risque d'épuisement. La recherche sur le VIH est un marathon de quatre décennies. L'afflux d'énergie et de financements porté par la technologie ARNm est une bouffée d'oxygène. Mais que se passera-t-il si, dans cinq ou sept ans, les essais de phase 2 ou 3 échouent, comme cela est arrivé si souvent par le passé ? La désillusion pourrait être à la hauteur des espérances actuelles. La communauté scientifique et les patients vivent sur un fil, entre l'espoir rationnel et la crainte du nouveau désastre.
L'horizon immédiat est jonché de dates précises qui scanderont les prochaines années. Les résultats intermédiaires de l'essai IAVI G002 sur le priming des précurseurs de bnAbs sont attendus pour le quatrième trimestre 2025. Moderna devrait publier les données de sécurité et d'immunogénicité initiales de son candidat mRNA-1644 d'ici la fin de l'année 2025. Le congrès de la Conference on Retroviruses and Opportunistic Infections (CROI) en mars 2026 sera un point d'étape critique, où les premières réponses cellulaires T induites par ces nouveaux vaccins seront passées au crible. Et dans les laboratoires, le travail sur les formulations muqueuses ARNm-LNP avance, avec des tests précliniques sur des modèles primates dont les résultats pourraient émerger dès 2026.
La prédiction la plus sûre est que le paysage en 2028 ne ressemblera pas à celui d'aujourd'hui. Soit nous aurons des données cliniques de phase 2 montrant une maturation d'anticorps prometteuse chez l'homme, ouvrant la voie à des essais d'efficacité monumentaux. Soit nous ferons face à un nouvel obstacle insurmontable, forçant une révision douloureuse des stratégies. Dans les deux cas, la technologie ARNm-LNP en sortira transformée, soit comme un outil victorieux, soit comme un instrument aux limites désormais mieux cartographiées.
Le 6 février 2025, la LNP X a esquissé une nouvelle frontière : celle de la délivrance ciblée au cœur même du sanctuaire du virus. Cette image, celle d'une nanoparticule lipidique naviguant délibérément vers une cellule T CD4 au repos pour y déposer un message de réveil ou de destruction, restera. Elle restera comme le symbole de cette nouvelle frontière, non plus entre la santé et la maladie, mais entre la biologie telle qu'elle est et la biologie telle que nous pourrions la reprogrammer. La question finale n'est pas de savoir si nous y parviendrons. La question est de savoir ce que nous apprendrons sur nous-mêmes en chemin, dans cet atelier où nous apprenons à sculpter non pas la pierre ou le métal, mais le vivant lui-même.
Your personal space to curate, organize, and share knowledge with the world.
Discover and contribute to detailed historical accounts and cultural stories. Share your knowledge and engage with enthusiasts worldwide.
Connect with others who share your interests. Create and participate in themed boards about any topic you have in mind.
Contribute your knowledge and insights. Create engaging content and participate in meaningful discussions across multiple languages.
Already have an account? Sign in here

L'IA crée en quelques minutes des milliers de molécules ciblées, diminue de dix le délai pré‑clinique et valide rapideme...
View Board
L'IA révolutionne la découverte de médicaments, compressant des années de recherche en mois, réduisant les coûts et ouvr...
View Board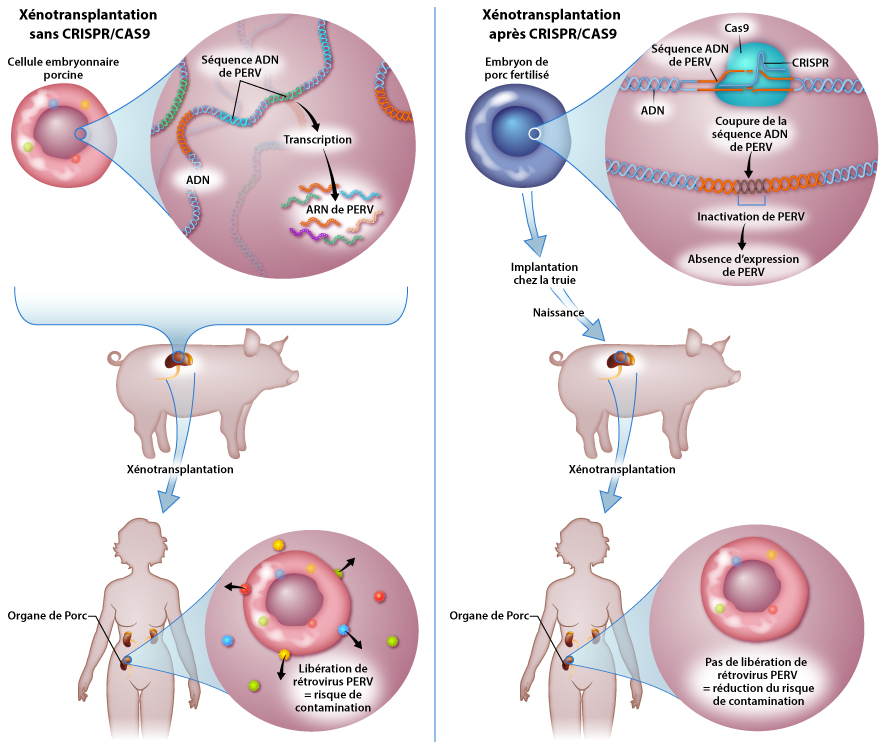
Un rein de porc génétiquement modifié par CRISPR a sauvé un patient en 2024, marquant un tournant historique dans la lut...
View Board
Découvrez Rosalyn Yalow, pionnière de la médecine nucléaire et co-développeuse du radioimmunoassay (RIA). Prix Nobel, el...
View Board
Découvrez la vie et l'héritage scientifique d'André Lwoff, biologiste français et prix Nobel pour ses découvertes sur la...
View Board
Le loup terrible, éteint depuis 10 000 ans, renaît dans un labo texan : trois louveteaux génétiquement modifiés, Romulus...
View Board
Krebskristalle im All: Medizinischer Quantensprung in Schwerelosigkeit Ein hellgrauer Punkt. Winzig, fast unscheinbar a...
View Board
Des chercheurs dévoilent un transistor synaptique qui détecte le mouvement en 100 µs, ouvrant la voie à une vision IA to...
View Board
L'écran et l'âme : le dilemme numérique de la santé mentale Mars 2024. Dans un cabinet parisien, une patiente décrit à ...
View Board
Plongez dans l'horreur préhistorique avec "Code Violet" sur PS5, où Violet Sinclair affronte des dinosaures intelligents...
View Board
Meta mise 2 milliards de dollars sur Manus, une startup d'IA rentable, pour dominer le marché des agents intelligents et...
View Board
Le cinéma français se réinvente en explorant de nouveaux territoires narratifs et sociaux, mêlant diversité culturelle e...
View Board
Le TinyML révolutionne l'électronique en intégrant une IA ultra-frugale dans les objets du quotidien, transformant therm...
View Board
Elon Musk confirme l'entrée en bourse de SpaceX en 2026, visant une valorisation record de 1 000 à 1 500 milliards de do...
View Board
Le bouquetin des Pyrénées, disparu en 2000, a brièvement ressuscité en 2003 grâce au clonage, mais cette tentative a rév...
View Board
Le duo nantais Cabadzi, entre beatbox virtuose et rap électronique, forge un son dystopique sombre, mêlant humour noir e...
View Board
KI-Wearables 2026 revolutionieren die Medizin: Präzisionsdiagnostik in Echtzeit, Edge-AI analysiert Vitaldaten direkt am...
View Board
Découvrez comment l'IA devient un collègue de travail en 2026, transformant les usines, les bureaux et les vignobles ave...
View Board
L'archéologie égyptienne entre dans une ère numérique où scanners à muons et IA décryptent les mystères des pyramides sa...
View Board
Archäologen entdecken auf Sulawesi eine 67.800 Jahre alte Handstencil – die älteste bekannte menschliche Kunst, die euro...
View Board
Comments