Curas da Edição Gênica CRISPR: Anemia Falciforme e Mais
A edição genética CRISPR está protagonizando uma revolução na medicina. De tratamentos aprovados para doenças do sangue a terapias personalizadas criadas em tempo recorde, os avanços do CRISPR redefinem o possível. Esta série explora as terapias mais recentes, os mecanismos por trás delas e seu impacto profundo em condições como a anemia falciforme.
O ano de 2025 tem sido marcante para o campo. Desde o primeiro caso de uma terapia base editing personalizada para um bebê até novos dados humanos para a tecnologia de prime editing, a velocidade dos progressos é extraordinária. Estas inovações estão transformando promessas de laboratório em realidades clínicas tangíveis.
Até fevereiro de 2025, cerca de 250 ensaios clínicos com CRISPR estavam ativos globalmente, abrangendo desde doenças genéticas raras até condições cardiovasculares.
Terapias CRISPR Aprovadas e em Fase Avançada
O cenário das terapias gênicas deu um salto histórico com a primeira aprovação regulatória de um tratamento baseado em CRISPR-Cas9. Essa conquista abriu caminho para uma nova geração de medicamentos que vão além do tratamento sintomático, visando a causa raiz de doenças genéticas.
A terapia conhecida como Casgevy (exagamglogene autotemcel) representa este marco. Ela foi aprovada para pacientes com anemia falciforme e beta-talassemia, duas doenças hereditárias do sangue. O sucesso deste tratamento validou todo o potencial da plataforma CRISPR e acelerou o desenvolvimento de outras terapias genéticas.
Casgevy: O Primeiro Tratamento CRISPR Aprovado
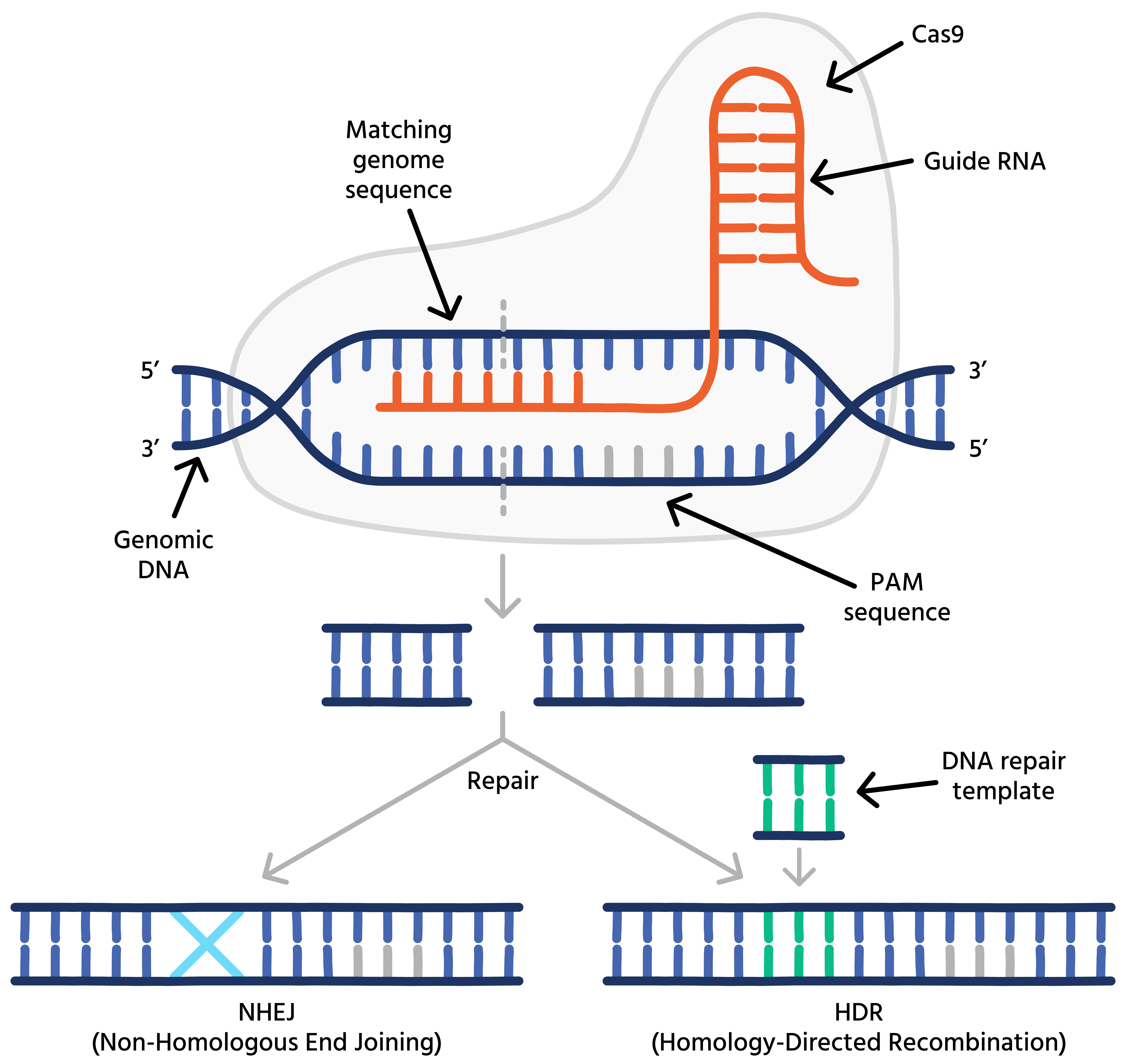
O Casgevy funciona por meio de uma abordagem conhecida como edição ex vivo. Células-tronco hematopoiéticas do paciente são coletadas e editadas em laboratório. A técnica de CRISPR-Cas9 é usada para direcionar um "interruptor" genético que reativa a produção de hemoglobina fetal (HbF).
A hemoglobina fetal, normalmente produzida apenas no período perinatal, não é afetada pela mutação causadora da doença. Ao reativar sua produção de forma eficaz, as células editadas, quando retransfundidas, podem gerar glóbulos vermelhos saudáveis. Os ensaios clínicos mostraram benefícios duradouros na redução de crises de dor e complicações severas.
Desafios da Terapia Pioneira
Apesar da eficácia revolucionária, o Casgevy enfrenta desafios significativos que destacam áreas para futuras melhorias nas terapias de edição gênica.
- Custo Elevado: O preço do tratamento aproxima-se dos US$ 2 milhões, criando uma barreira substancial para o acesso em grande escala.
- Complexidade do Procedimento: O processo exige quimioterapia condicionante para abrir espaço na medula óssea antes do retransplante das células editadas, um procedimento invasivo com riscos.
- Infraestrutura Necessária: A natureza ex vivo requer centros médicos especializados para coleta, manipulação e infusão das células.
Estes desafios têm impulsionado a pesquisa em direção a métodos de entrega mais simples, como as terapias in vivo, que buscam editar as células diretamente dentro do corpo do paciente, eliminando a necessidade do complexo processo de transplante.
Inovações de 2025: Para Além do Corte de DNA
A próxima fronteira das terapias de edição genética CRISPR está nas tecnologias que evitam cortar a dupla fita de DNA. As abordagens tradicionais com Cas9, embora poderosas, geram preocupações com segurança devido a potenciais edições off-target e reações celulares imprevisíveis.
Para superar essas limitações, os cientistas desenvolveram ferramentas de precisão ainda maior. Estas inovações incluem o base editing e o prime editing, que realizam alterações genéticas pontuais sem fazer quebras duplas no DNA. Essas tecnologias representam um avanço crucial na busca por tratamentos mais seguros.
Base Editing: Corrigindo Letras Únicas do Código Genético
O base editing é uma ferramenta de precisão cirúrgica. Ele permite converter diretamente uma única "letra" do DNA (um nucleotídeo) em outra, sem cortar a fita. Esse mecanismo é ideal para corrigir mutações pontuais que são a causa de centenas de doenças genéticas.
Em janeiro de 2024, a Beam Therapeutics iniciou um ensaio de Fase I/II nos EUA utilizando base editing para tratar anemia falciforme. O estudo continua ativo em 2025, representando uma das primeiras aplicações clínicas desta tecnologia elegante. O objetivo é produzir um efeito terapêutico duradouro com um perfil de segurança potencialmente melhorado.
Prime Editing: O "Editor de Texto" Genético
O prime editing leva a precisão a um novo patamar. Frequentemente descrito como um "editor de texto" para o DNA, ele pode inserir, deletar ou substituir sequências genéticas com extrema exatidão. Essa flexibilidade o torna uma plataforma versátil para corrigir uma gama mais ampla de mutações.
Em maio de 2025, a Prime Medicine reportou os primeiros dados humanos de uma terapia de prime editing. O alvo foi a doença granulomatosa crônica (DGC), uma imunodeficiência primária. O tratamento focou em mutações no gene NCF1, que são responsáveis por cerca de 25% dos casos da doença. Os resultados iniciais demonstraram eficácia e um perfil de segurança promissor, validando esta nova geração de tecnologia CRISPR.
Terapia Personalizada em Tempo Recorde: O Caso KJ
Um dos marcos mais impressionantes de 2025 demonstrou a agilidade potencial da edição genética CRISPR. No Hospital Infantil da Filadélfia, uma equipa concebeu, desenvolveu e administrou uma terapia totalmente personalizada para um bebê com uma rara deficiência de CPS1 em apenas seis meses.
Esta condição metabólica grave, sem tratamentos eficazes, exigia uma solução urgente. Os médicos e cientistas projetaram um editor de bases específico para a mutação exata do paciente, conhecido como KJ. A terapia foi fabricada sob medida e as infusões ocorreram entre fevereiro e abril de 2025. Os resultados iniciais após o tratamento foram promissores.
Este caso estabeleceu um precedente crítico. Ele prova que, para doenças genéticas raras e fatais, é possível desenvolver uma terapia de edição genética personalizada em um cronograma clinicamente relevante. Isso abre uma nova porta de esperança para famílias que enfrentam diagnósticos de doenças ultra-raras e sem opções terapêuticas.
O Impacto da Personalização
A abordagem para o paciente KJ exemplifica a convergência entre diagnóstico genético avançado e fabricação ágil de terapias. A capacidade de criar um tratamento "sob medida" rapidamente é um divisor de águas. Ela sugere um futuro onde a medicina genómica personalizada se torna uma realidade prática, não apenas um conceito distante.
Edição Epigenética: Uma Abordagem Sem Corte para a Anemia Falciforme
Uma das inovações mais fascinantes de 2025 é o desenvolvimento de ferramentas CRISPR que não cortam o DNA. Pesquisadores da UNSW Sydney revelaram um novo sistema que atua no nível epigenético. Em vez de alterar a sequência de DNA, ele remove grupos metil, que são marcas químicas que silenciam genes.
Esta técnica foi aplicada com sucesso para reativar o gene da hemoglobina fetal (HbF) em modelos de laboratório. A reativação epigenética da HbF oferece uma nova rota terapêutica potencial para a anemia falciforme e a beta-talassemia. O grande diferencial é a eliminação do risco associado a quebras de dupla fita no DNA, um marco importante para a segurança.
A nova ferramenta epigenética demonstrou reduzir significativamente os riscos de edições off-target, um dos principais desafios de segurança nas terapias tradicionais com CRISPR-Cas9.
Como Funciona a Edição Epigenética CRISPR
A abordagem utiliza uma versão inativa da proteína Cas9, conhecida como "dead Cas9" (dCas9). Esta proteína é guiada até o gene alvo, mas não corta o DNA. Em vez disso, ela carrega enzimas que removem as marcas de metilação que mantêm o gene silenciado.
Ao eliminar esse bloqueio químico, a célula naturalmente volta a produzir a hemoglobina fetal. Esta estratégia aproveita um mecanismo biológico próprio do organismo, tornando-a menos invasiva do que a edição permanente do código genético.
- Segurança Aprimorada: Sem cortes no DNA, há menos risco de mutações indesejadas ou recombinações genéticas perigosas.
- Reversibilidade Potencial: As mudanças epigenéticas podem ser potencialmente reversíveis, oferecendo um nível diferente de controle terapêutico.
- Aplicação Ampliada: Esta tecnologia pode ser adaptada para outras doenças onde a reativação de um gene benéfico é a estratégia, não a correção de uma mutação.
Expansão para Doenças Comuns: Coração e Fígado
O sucesso em doenças sanguíneas está abrindo caminho para aplicações do CRISPR em algumas das maiores causas de morbidade e mortalidade no mundo: as doenças cardiovasculares e hepáticas. Empresas estão desenvolvendo terapias in vivo que podem ser administradas diretamente no corpo, como uma infusão ou injeção.
Essa transição de tratamentos ex vivo complexos para terapias in vivo mais simples é crucial para o acesso em larga escala. A aquisição da Verve Therapeutics pela gigante farmacêutica Eli Lilly, em junho de 2025, é um testemunho do enorme potencial comercial e clínico visto na edição de genes para condições crônicas.
Terapias In Vivo para o Fígado
O fígado é um órgão-alvo privilegiado para terapias in vivo devido à sua capacidade de absorver nanopartículas lipídicas (LNPs). Estas LNPs atuam como veículos microscópicos que carregam as ferramentas de edição genética até as células hepáticas.
Várias empresas estão explorando esta via. A Tune Therapeutics recebeu aprovação da FDA no final de 2024 para iniciar um ensaio de Fase Ib com o TUNE-401, um tratamento para a hepatite B (HBV) que usa edição epigenética. A abordagem visa silenciar permanentemente o DNA viral do HBV, potencialmente levando a uma cura funcional.
A HuidaGene também relatou resultados impressionantes em ensaios clínicos para deficiência de alfa-1 antitrypsin (DAAT), uma doença hepática e pulmonar genética. Seu tratamento, administrado por LNPs, demonstrou produzir cerca de 90% de proteína AAT saudável no dia 14, com níveis mantidos no dia 28 na dose mais alta. Esta é uma prova de conceito poderosa para a eficácia do in vivo.
Combate ao Colesterol com CRISPR
As doenças cardiovasculares representam o próximo grande desafio. A Verve Therapeutics (agora parte da Eli Lilly) está liderando o desenvolvimento de terapias de edição de genes de dose única para reduzir permanentemente os níveis de colesterol LDL, o "colesterol ruim".
A estratégia envolve editar um gene no fígado chamado PCSK9, que regula os receptores de LDL. Ao silenciar este gene, o corpo pode remover mais eficientemente o LDL da corrente sanguínea. Essa abordagem poderia substituir a necessidade de medicamentos diários para milhões de pacientes.
- Dose Única, Efeito Duradouro: A edição genética oferece a perspectiva de uma intervenção única com benefícios que podem durar anos ou toda a vida.
- Alta Adesão: Elimina o problema da baixa adesão aos medicamentos tradicionais, que devem ser tomados diariamente.
- Impacto em População: Tem o potencial de beneficiar uma parcela enorme da população global, tornando a escala de produção um foco crítico.
Acelerando o Progresso com Inteligência Artificial
O design de terapias de edição genética CRISPR é um processo complexo. Encontrar as sequências-guia mais eficientes e seguras, prever efeitos off-target e otimizar os sistemas de entrega são desafios computacionais massivos. É aqui que a Inteligência Artificial (IA) está entrando em cena como um catalisador essencial.
Em 2025, pesquisadores de Stanford apresentaram o CRISPR-GPT, uma ferramenta de IA que automatiza o planejamento de experimentos de edição genética. O sistema foi treinado em uma década de dados científicos, permitindo-lhe prever resultados e projetar estratégias com alta precisão.
O CRISPR-GPT permitiu que pesquisadores novatos no campo realizassem experimentos complexos de edição genética com sucesso em sua primeira tentativa, reduzindo a curva de aprendizado de meses para dias.
Como a IA Está Transformando o Campo
A IA está sendo aplicada em múltiplas frentes do desenvolvimento de terapias CRISPR. Ela acelera a descoberta ao analisar vastos conjuntos de dados genómicos para identificar os melhores alvos terapêuticos. Além disso, modelos preditivos estão sendo usados para prever a eficácia e a segurança de diferentes desenhos de editores genéticos.
Esta sinergia entre IA e CRISPR está reduzindo drasticamente o tempo e o custo necessários para levar uma terapia do conceito para o ensaio clínico. Para doenças raras, onde o tempo é crítico, essa aceleração pode significar a diferença entre vida e morte.
Impacto na Personalização e Acesso
O caso da terapia personalizada para o paciente KJ com deficiência de CPS1 foi viabilizado por avanços tecnológicos que incluem ferramentas de design assistido por computador. A IA pode ajudar a projetar rapidamente editores de base específicos para uma mutação única, abrindo caminho para um futuro onde terapias sob medida se tornem mais viáveis.
Além disso, a otimização por IA dos sistemas de entrega, como as nanopartículas lipídicas, pode levar a terapias in vivo mais eficazes e acessíveis. Ao reduzir os custos de desenvolvimento e aumentar a eficiência, a IA tem o potencial de democratizar o acesso às terapias de edição genética no longo prazo.
A Versatilidade do Prime Editing: Um Sistema para Múltiplas Doenças
Uma das descobertas mais promissoras recentemente é o potencial de um sistema único de prime editing para tratar diversas doenças genéticas. Pesquisadores do Broad Institute demonstraram que um editor primário pode ser projetado para visar mecanismos moleculares comuns a várias condições.
Isto é particularmente relevante para o vasto universo das doenças raras. Muitas dessas enfermidades, embora diferentes em suas manifestações, são causadas por tipos semelhantes de erros no DNA, como mutações pontuais específicas ou pequenas inserções.
Estima-se que um sistema de prime editing bem direcionado possa abordar os mecanismos causais em aproximadamente 30% das doenças raras de origem genética, oferecendo uma plataforma versátil para desenvolvimento acelerado de terapias.
Economia de Escala na Medicina de Precisão
Esta abordagem representa uma mudança de paradigma. Em vez de desenvolver uma terapia completamente nova do zero para cada doença ultra-rara, os cientistas poderiam adaptar uma plataforma central de prime editing. O "editor" principal permaneceria o mesmo, enquanto a sequência-guia de RNA seria personalizada para a mutação específica de cada paciente ou doença.
Isso poderia reduzir drasticamente o tempo e os custos de desenvolvimento. A fabricação, os testes de segurança e os processos regulatórios para a plataforma principal já estariam estabelecidos, acelerando o caminho para os pacientes que não têm tempo a perder.
Desafios Persistentes e Barreiras ao Acesso
Apesar do progresso vertiginoso, o caminho para tornar as terapias de edição genética CRISPR uma realidade amplamente acessível ainda enfrenta obstáculos significativos. Estes desafios são técnicos, logísticos e, sobretudo, econômicos.
O caso do Casgevy é ilustrativo: uma cura funcional com um preço próximo a US$ 2 milhões. Este custo proibitivo reflete a complexidade da manufatura ex vivo, a infraestrutura hospitalar especializada necessária e os altos custos de pesquisa e desenvolvimento amortizados sobre um número inicialmente pequeno de pacientes.
Os Grandes Obstáculos a Serem Superados
- Entrega Eficiente e Segura (In Vivo): Embora as LNPs para o fígado sejam promissoras, entregar editores com precisão a outros órgãos, como o cérebro, músculos ou pulmões, permanece um enorme desafio técnico.
- Respostas Imunológicas: O sistema imunológico do paciente pode reconhecer e atacar os componentes da terapia CRISPR (como a proteína Cas), neutralizando seu efeito ou causando reações adversas.
- Editores Off-Target: Garantir que as edições ocorram apenas no local exato desejado no genoma é primordial para a segurança a longo prazo. Tecnologias como base e prime editing reduzem, mas não eliminam totalmente, esta preocupação.
- Equidade Global no Acesso: Existe um risco real de que essas terapias transformadoras se tornem disponíveis apenas em países ricos, aprofundando as disparidades globais em saúde. Modelos de financiamento e parcerias internacionais são urgentemente necessários.
Perspectivas Futuras: O Horizonte da Edição Gênica
O futuro próximo das terapias CRISPR será moldado pela convergência de várias frentes de inovação. A tendência é clara: ir além das doenças sanguíneas raras para enfrentar condições comuns, com métodos cada vez mais seguros e administráveis.
A integração contínua da Inteligência Artificial irá refinar ainda mais o design de terapias, prever resultados com maior precisão e personalizar tratamentos em uma velocidade sem precedentes. A automação no laboratório e na análise de dados tornará o processo de desenvolvimento mais ágil e menos propenso a erros.
Combinação de Tecnologias e Terapias
O futuro pode ver a combinação de diferentes modalidades de edição. Por exemplo, uma terapia poderia usar epigenetic editing para reativar temporariamente um gene enquanto um editor de bases corrige permanentemente a mutação subjacente em um ritmo mais lento. Esta abordagem em "camadas" poderia oferecer benefícios imediatos e soluções de longo prazo.
Além disso, a edição genética CRISPR pode ser combinada com outras modalidades terapêuticas, como a imunoterapia para o câncer. Editar células do sistema imunológico do paciente (células CAR-T) para torná-las mais potentes e específicas contra tumores é uma área de pesquisa extremamente ativa e promissora.
A Expansão do Universo de Doenças Tratáveis
Os ensaios clínicos já estão explorando novas fronteiras. Para além das doenças já mencionadas, há pesquisas em andamento para aplicar o CRISPR em:
- Doenças Neurodegenerativas: Como a doença de Huntington e a ELA, visando silenciar genes mutantes ou produzir fatores neuroprotetores.
- HIV/AIDS: Estratégias para eliminar o vírus integrado no genoma das células ou editar receptores que o vírus usa para entrar nas células.
- Doenças Oculares Hereditárias: A entrega local ao olho é relativamente mais simples, tornando-o um alvo ideal para algumas formas de cegueira genética.
- Doenças Inflamatórias e Autoimunes: Modulando a resposta imunológica através da edição de genes em células específicas do sistema imune.
Considerações Éticas e o Caminho a Seguir
O poder extraordinário da edição genética CRISPR vem acompanhado de uma responsabilidade ética profunda. Enquanto a comunidade científica se concentra em terapias somáticas (que editam células do corpo não hereditárias), o debate sobre a edição da linha germinativa (que seria passada para futuras gerações) permanece intensamente restrito e, na maioria dos países, proibido.
Os ensaios clínicos atuais seguem rigorosos protocolos de ética e segurança. O foco principal deve permanecer no desenvolvimento de curas para doenças debilitantes e fatais, garantindo o consentimento informado dos pacientes e a transparência sobre riscos e benefícios.
A medicina do futuro, moldada pelo CRISPR, deve ser guiada por um princípio fundamental: equidade. O objetivo final não é apenas a cura, mas a cura acessível a todos que dela precisam, independentemente de sua origem geográfica ou condição socioeconômica.
Conclusão: Uma Nova Era na Medicina
Os avanços do CRISPR entre 2024 e 2025 pintam o retrato de um campo em rápida maturação. Partimos da primeira terapia aprovada para chegar a demonstrações de conceito de tecnologias de segunda e terceira geração em humanos, como o prime editing e a edição epigenética, em um espaço de tempo extraordinariamente curto.
A história de sucessos recentes é marcante: a cura funcional para a anemia falciforme, a terapia personalizada desenvolvida em seis meses para um bebê, a redução de 90% de uma proteína defeituosa no fígado e os primeiros dados humanos com editores que não cortam o DNA. Cada um desses marcos é um testemunho do engenho científico e uma fonte de esperança renovada para milhões.
No entanto, o caminho à frente exige um equilíbrio cuidadoso entre otimismo e pragmatismo. Os desafios de entrega, segurança, custo e acesso são reais e substanciais. A colaboração global entre cientistas, médicos, empresas, governos e defensores dos pacientes será essencial para superá-los.
A edição genética CRISPR não é mais uma promessa distante; é uma ferramenta terapêutica que já está alterando destinos hoje. À medida que refinamos suas capacidades e expandimos seu alcance, estamos testemunhando o amanhecer de uma nova era na medicina: uma era de curas precisas, profundas e, com esforço e compromisso coletivo, verdadeiramente transformadoras para a humanidade.





Comments